Dlaczego GIF zdecydował się na tak radykalny krok? 🔍
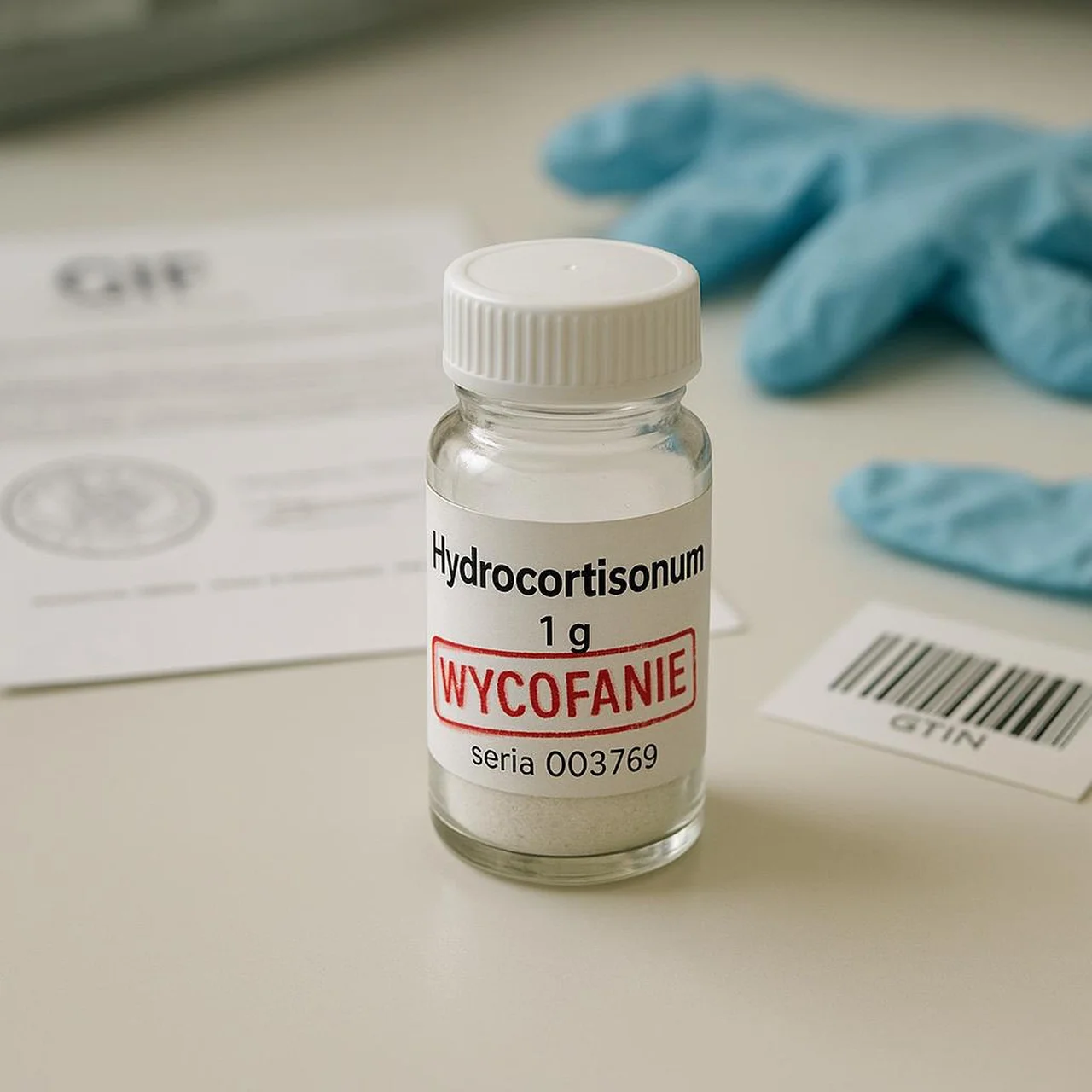
Decyzja nr 26/WC/ZW/2025, podpisana 25 lipca 2025 r. przez Dyrektora Generalnego Marcina Wójtowicza „z up. Głównego Inspektora Farmaceutycznego”, jest reakcją na poważne ryzyko zdrowotne. Podczas wewnętrznej kontroli w zakładzie Przedsiębiorstwa Produkcyjno-Handlowego Galfarm w Krakowie odkryto, że w trakcie etykietowania surowca Lidokainy chlorowodorku jednowodnego prowadzono równoległe napełnianie opakowań surowca Hydrokortyzon 1 g. Oba produkty trafiały do identycznych pojemników z białą zakrętką, co otworzyło drogę do potencjalnej zamiany zawartości. 😱
GIF, powołując się na art. 122 ust. 1 Prawa farmaceutycznego, uznał, że nie można jednoznacznie wykluczyć pomyłki w całym łańcuchu dystrybucji. W efekcie w aptekach mogłoby dojść do sytuacji, w której receptura przewidująca hydrokortyzon zostanie przygotowana z faktyczną zawartością lidokainy, lub odwrotnie. To natychmiast przełożyłoby się na brak skuteczności terapii, a w skrajnych przypadkach – na niebezpieczne działania niepożądane.
Jakie serie i dane identyfikacyjne są zagrożone? 🆔
• Nazwa handlowa: Hydrocortisonum 1 g • Numer serii: 003769 • Data ważności: 09.2026 • Kod GTIN: 5909990079834 • Podmiot odpowiedzialny: PPH „Galfarm” sp. z o.o. • Numer pozwolenia: 13616
GIF nie ograniczył się jedynie do wycofania hydrokortyzonu. Już 3 lipca br. organ wydał bliźniaczą decyzję (23/WC/ZW/2025) dotyczącą serii lidokainy 003029 z datą ważności 09.2027. W tamtym przypadku „podejrzany wygląd proszku i brak możliwości rozpuszczenia w wodzie” zgłosiła apteka, co uruchomiło całą lawinę kontroli.
Źródło decyzji GIF: https://www.gov.pl/web/gif/dec-26wczw2025 https://www.gov.pl/web/gif/dec-23wczw2025
Co oznacza „rygor natychmiastowej wykonalności”? ⚡️
Zgodnie z art. 108 § 1 Kodeksu postępowania administracyjnego organ może nadać taki rygor, gdy jest to niezbędne dla ochrony zdrowia lub życia. W praktyce oznacza to, że decyzja wchodzi w życie w chwili doręczenia stronie, bez względu na ewentualne odwołanie. Apteki, hurtownie i szpitale muszą więc bezzwłocznie:
- Zablokować sprzedaż opisanej partii. 🚫
- Fizycznie oddzielić ją od pełnowartościowych surowców. 📦
- Zgłosić stan magazynowy i plan zwrotu do dostawcy. 📝
Brak reakcji podmiotu może skutkować dotkliwymi karami finansowymi – nawet do 500 000 zł, zgodnie z art. 127c Prawa farmaceutycznego.
Instrukcje dla aptek i hurtowni 🔄
1. Natychmiastowa weryfikacja stanów magazynowych
W pierwszej kolejności farmaceuci powinni przejrzeć wszystkie pojemniki hydrokortyzonu w gramaturze 1 g. Kluczowy jest numer serii – jeżeli to 003769, produkt musi zostać zabezpieczony. Podobną procedurę zastosuj dla ewentualnych zapasów lidokainy 1 g, seria 003029.
2. Oznaczenie i kwarantanna
Produkt objęty wycofaniem trzeba oznaczyć etykietą „NIE UŻYWAĆ – WYCOFANIE GIF” i przenieść do wydzielonego, zamkniętego miejsca magazynowego. 🔐
3. Zgłoszenie do hurtowni lub bezpośrednio do Galfarm
Producent ma prawny obowiązek przyjąć zwrot oraz pokryć koszty transportu i utylizacji. Formularz zwrotu można pobrać z oficjalnej strony Galfarm link.
4. Dokumentacja GMP i GDP
Wszystkie czynności muszą być odnotowane w rejestrze reklamacyjnym oraz w systemie jakości. Brak kompletnej dokumentacji to prosta droga do nieprzyjemności podczas kolejnej inspekcji WIF. 😬
Co powinni zrobić pacjenci? 👩⚕️👨⚕️
Choć hydrokortyzon w gramaturze 1 g jest typowym surowcem recepturowym, sporadycznie bywa kupowany przez pacjentów do samodzielnego przygotowania maści (co oczywiście nie jest rekomendowane). Jeśli w Twojej domowej apteczce znajduje się opakowanie z numerem serii 003769, wykonaj trzy kroki:
- Nie używaj preparatu.
- Sprawdź paragon lub fakturę – potwierdzą one miejsce zakupu.
- Zwróć produkt w aptece; farmaceuta ma obowiązek przyjąć zwrot i wydać potwierdzenie.
Zgodnie z art. 96 ust. 5 ustawy Prawo farmaceutyczne, zwrot produktu wycofanego z obrotu nie wymaga okazania paragonu, ale ułatwia procedurę.
Potencjalne skutki terapeutyczne pomyłki 💊
– Hydrokortyzon to glikokortykosteroid o działaniu przeciwzapalnym. – Lidokaina to miejscowy środek znieczulający.
Zamiana tych substancji prowadzi do dramatycznych konsekwencji klinicznych. Przykładowo, maść recepturowa przygotowana rzekomo z hydrokortyzonem, ale faktycznie zawierająca lidokainę, nie zahamuje stanu zapalnego, a pacjent może odczuć jedynie krótkotrwałe znieczulenie. Odwrotna sytuacja – zastosowanie steroidu zamiast lidokainy w żelu przeciwbólowym – może skutkować przerzedzeniem skóry, teleangiektazjami, a nawet układowymi działaniami kortykosteroidowymi przy długotrwałym stosowaniu. 🩹
Gdzie szukać oficjalnych informacji? 🌐
- Portal GIF – sekcja „Decyzje i komunikaty” https://www.gov.pl/web/gif
- Rejestr serii wycofanych – baza „ZSMOPL” https://zsmopl.ezdrowie.gov.pl/
- Komunikaty Naczelnej Izby Aptekarskiej https://www.nia.org.pl/
Reakcja branży farmaceutycznej 🏭
Polskie Stowarzyszenie Przemysłu Farmaceutycznego (PSPF) w oficjalnym stanowisku podkreśliło, że przypadek Galfarmu „dowodzi potrzeby inwestowania w zaawansowane systemy serializacji i automatycznego wykrywania błędów pakowania”. Organizacja apeluje również o wdrożenie rozwiązań blockchain w śledzeniu partii surowców – podobnie jak zrobiły to już niektóre koncerny w Niemczech i Holandii.
Z kolei Krajowa Izba Gospodarcza Aptek podkreśla, że większość placówek w Polsce pracuje na minimalnym stanie osobowym. Każdy kolejny incydent jakościowy to dodatkowe obciążenie kadrowe – farmaceuci muszą sporządzać raporty, segregować towar i tłumaczyć procedury pacjentom.
Czy to odosobniony przypadek? 📉📈
Statystyki GIF wskazują, że w 2024 r. wycofano z rynku 41 serii surowców recepturowych, a w pierwszym półroczu 2025 r. już 29. Najczęstsze przyczyny to:
• niewłaściwa zawartość substancji czynnej (34 %) • zanieczyszczenia mikrobiologiczne (27 %) • błędne oznakowanie (22 %) • problemy z rozpuszczalnością (17 %)
Źródło danych: „Raport GIF 2024” https://www.gov.pl/attachment/raport-gif2024
Rosnąca liczba decyzji sugeruje, że kontrola jakości w segmencie recepturowym wymaga dodatkowych nakładów. Pojawiają się głosy o konieczności centralizacji wytwarzania surowców i zwiększenia roli wytwórców kontraktowych o standardzie GMP EU.
Jak zabezpieczyć się na przyszłość? 🔒
- Usprawnij identyfikację wizualną – różne kolory zakrętek, unikalne kształty fiolek i etykiety odporne na odklejanie.
- Wprowadź podwójną kontrolę podczas pakowania: skan kodu 2D + weryfikacja wzrokowa.
- Szkolenia personelu – co pół roku kurs z zakresu GDP i analizy ryzyka.
- Audyt dostawców – zwróć uwagę na sposób zarządzania etykietami i bilans materiałów.
- Komunikacja z aptekami – newslettery alarmowe, SMS-y i dedykowana infolinia.
Podsumowanie 📝
Wycofanie serii 003769 hydrokortyzonu pokazuje, jak niewielki błąd w procesie pakowania może przerodzić się w kryzys obejmujący cały kraj. Bezpieczeństwo leków to nie tylko formalność, ale wspólna odpowiedzialność producentów, hurtowników, aptek i pacjentów. Jeżeli masz do czynienia z jakąkolwiek partią leku budzącą wątpliwości:
• Sprawdź numer serii i datę ważności. • Skontaktuj się z apteką lub bezpośrednio z GIF. • Nie wahaj się zgłosić podejrzenia wady – każda informacja może zapobiec tragedii.
Na koniec warto podkreślić słowa GIF: „Dla ochrony zdrowia i życia pacjentów działamy natychmiast”. Dzięki szybkim reakcjom systemu nadzoru farmaceutycznego możemy czuć się bezpieczniej, nawet w obliczu nieprzewidzianych zdarzeń. 🛡️